
新股消息 | 康諾亞生物遞表港交所主板,公司的產品尚未獲準進行商業銷售

4 月 8 日披露,康諾亞生物醫藥科技有限公司向港交所主板申請上市,大摩、中金公司、華泰國際為其聯席保薦人。
智通財經 APP 獲悉,據港交所 4 月 8 日披露,康諾亞生物醫藥科技有限公司 (以下簡稱 “康諾亞生物”) 向港交所主板申請上市,大摩、中金公司、華泰國際為其聯席保薦人。

康諾亞生物是一家生物科技公司,擁有多種臨牀階段的資產,每種資產均為其各自競爭領域中的有力競爭者。公司專注於自主發現及開發創新生物療法以滿足自體免疫及腫瘤治療領域中未獲滿足的大量醫療需求。
公司的核心業務模式是基於差異化或經臨牀驗證的作用機制自行發現及開發創新療法。為配合內部研發工作,公司亦通過合資企業或對外授權安排與第三方合作開發及商業化公司的候選藥物。招股書顯示,公司和多個知名藥企展開合作,其中包括石藥集團 (01093)、樂普生物、天廣實、諾誠健華 (09969)。
公司產品
公司目前研發中的產品及對已進入臨牀階段的候選藥物及選定的可進入臨牀試驗申請階段的候選藥物開發狀態:
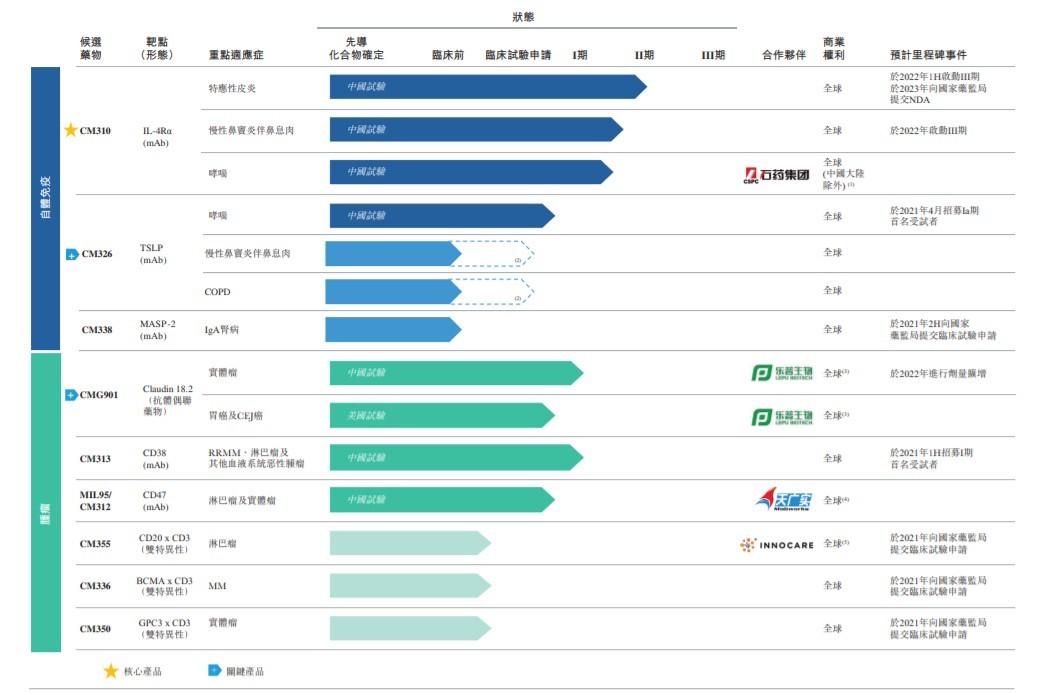
公司的核心產品為 CM310(IL-4Rα抗體),是多種臨牀試驗中的一種針對白介素 4 受體α亞基 (IL-4Rα) 的人源化及高效的拮抗劑抗體。其為首個國產且獲得中國國家藥品監督管理局 (國家藥監局) 的臨牀試驗申請批准的 IL-4Rα抗體。通過靶向 IL-4Rα,CM310 阻斷白介素 4 (IL-4) 及白介素 13 (IL-13) 的信號傳導。IL-4 及 IL-13 為引發 II 型炎症的兩種關鍵細胞因子。
公司的主要候選藥物包括 CM326(TSLP 抗體) 和 CMG901(Claudin 18.2 抗體偶聯藥物)。其中,CM326 是針對胸腺基質淋巴細胞生成素 (TSLP) 的人源化高效單克隆抗體。其為中國首個全世界第三個獲臨牀試驗申請批准的國產 TSLP 靶向抗體。CMG901 是靶向 Claudin 18.2 的抗體偶聯藥物,含 Claudin 18.2 特異性抗體、可裂解連接子及毒性載荷單甲基澳瑞他汀 E (MMAE)。其為首個在中國及美國取得臨牀試驗申請的 Claudin 18.2 抗體偶聯藥物。
財務狀況
招股書顯示,康諾亞生物的產品尚未獲準進行商業銷售,因此尚未從產品銷售中產生任何收入。自公司成立以來,公司每年產生經營虧損。於 2019 年及 2020 年,公司分別產生全面虧損總額 1.68 億元及 8.19 億元。全面虧損總額主要來源於研發開支、行政開支及可轉換可贖回優先股公允價值虧損。
公司預期在至少未來幾年經營開支會增加,因為公司需要進一步進行臨牀前研究、繼續進行候選藥物的臨牀開發、就候選藥物尋求監管批准及製造候選藥物、推出的在研產品以及增聘必要人員以經營公司的業務。

募資用途
(1) 約 40% 的資金將用於正在進行及計劃開展的臨牀試驗,籌備公司的核心產品 CM310(IL-4Rα抗體) 的註冊備案及計劃開展的商業化上市;
(2) 約 10% 的資金將通過對公司與樂普生物的合資企業 KYM 進行注資而將用於正在進行及計劃開展的 CMG901 (Claudin 18.2 抗體偶聯藥物) 臨牀試驗,包括但不限於正在中國進行的晚期實體瘤 I 期臨牀試驗;
(3) 約 10% 的資金將用於正在進行及計劃開展的臨牀試驗來評估 CM326(TSLP 抗體) 治療哮喘患者,包括但不限於 la 期的健康對象:
(4) 約 15% 的資金將用於公司其他管線產品的臨牀前評估及臨牀開發,包括 CM313(CD38 抗體)、MIL95/CM312 (CD47 抗體)、CM338(MASP-2 抗體)、CM355(CD20xCD3 雙特異性)、 CM350(GPC3xCD3 雙特異性) 及 CM336(BCMAxCD3 雙特異性)。
(5) 約 15% 的資金將用於公司新生產及研發設施的租賃付款,及購買機械及設備。公司預計在 2022 年完成第一階段新商業化規模生產設施,預計將為公司提供 16,000L 的額外產能。
(6) 約 10% 的資金將用於公司的一般企業及營運資金用途。

