
科济药业-B:全球创新,实体瘤 CAR-T 领跑

同业竞争中存在差异化优势
随着国内细胞治疗领域开始步入血液瘤的商业化阶段,众多细胞治疗领域玩家也开始进入投资者的观察名单之中。
在这份名单之中,有在血液瘤领域获批的实力玩家,也有在更难以攻克但市场更大的实体瘤领域扎根的新兴玩家。在逐渐火热的细胞治疗领域中,有真研发实力,走差异化路线的创新药企,才能从中脱颖而出。
值得注意的是,自 2021 年四季度以来,作为实体瘤 CAR-T 领域的领头羊,科济药业动作频频,在药物研发、国际化进程上均取得一定成果,进一步展示公司在细胞治疗领域的强大实力与竞争力。此外,公司成功入选 “沪港通” 名单,3 月 7 日起正式生效,将有望大幅提升交易流动性,从而实现公司投资价值。
在 2022 年医药板块投资风格从 beta 转变为 alpha 之下,这些公司动态对于科济药业意味着什么,又在释放着什么样的信息与投资机会?
公司关键动态速读:

1
CT041:实体瘤 CAR-T 研发领跑全球
作为免疫治疗中最为火热的治疗方式之一,CAR-T细胞治疗在血液瘤领域表现出色,目前在全球市场已经有多款针对血液瘤的CAR-T细胞治疗产品获批上市。
然而,血液瘤市场仅仅是肿瘤领域的一小部分,约 90% 的肿瘤均为实体瘤。从研发进度上来看,当前尚未有实体瘤 CAR-T 进入商业化阶段。可以预见的是,CAR-T 细胞疗法将会向实体瘤领域进军,迈向成熟的商业化阶段,其中跑得最快的玩家就是科济药业。
科济药业正在进行临床试验研究的 CT041 是科济药业自主研发的一种潜在全球同类首创的 CAR-T 候选产品,主要治疗胃癌/食管胃结合部腺癌及胰腺癌。
截至公告日,CT041 为全球唯一已获得美国 FDA 和中国国家药监局及加拿大卫生部的 IND/CTA 批准、并正在进行临床试验研究的靶向 CLDN18.2 的 CAR-T 细胞候选产品。CT041 于 2020 年获得美国 FDA 授予孤儿药资格认定,用于治疗胃癌/食管胃结合部腺癌,并于 2021 年获得 EMA 授予孤儿药产品认定,以及 “优先药物(PRIME)” 资格,用于治疗晚期胃癌,成为全球首个入选 PRIME 计划的实体瘤 CAR-T 产品。
2022 年 1 月,CT041 被美国食品药品监督管理局(FDA)授予 “再生医学先进疗法”(RMAT)资格,用于治疗 CLDN18.2 阳性的晚期胃癌/食管胃结合部腺癌(GC/GEJ)。据公开可查的资料,这是全球首个获得 RMAT 资格的实体瘤 CAR-T 产品,科济药业也成为唯一一家两个核心候选产品均获得 RMAT 资格的中国 CAR-T 公司。
作为具有 FIC 潜力的 CT041 产品,其优势也非常显著:
(1)解决临床治疗需求。
(2)创新治疗方案。
(3)临床数据优。
(4)靶点先发优势显著。
本次 CT041 获国家药品监督管理局药品审评中心(CDE)批准进入确证性Ⅱ期临床试验也进一步验证了前期临床数据的有效性。若后续临床试验能取得如计划的成功,CT041 有望成为全球首个在 CAR-T 领域治疗胃癌的产品,直面远大于血液瘤领域的实体瘤领域市场,为实体瘤治疗格局带来革命性变化。
未来,结合前期公司针对晚期胃癌/食管胃结合部腺癌和胰腺癌以及在北美针对晚期胃癌或胰腺癌的临床试验布局,科济药业有望能够挖掘 CLDN18.2 靶点在更多适应症的应用,从而与同类细胞治疗公司实现错位竞争,并带来中长期稳定价值。

2
CT053:ASH 会议公布亮眼数据
国内 R/R MM 治疗或迎革命性药物
除了在实体瘤领域,科济药业在血液瘤领域的临床数据也表现亮眼。2021 年 12 月上旬,美国血液学会(ASH)年会上研究人员以壁报形式发布了 CT053 相关研究数据。
CT053 是一种升级的、用于治疗复发/难治多发性骨髓瘤的全人抗自体 BCMA CAR-T 细胞候选产品。其融合了科济药业设计的升级版 CAR 结构,具有较低免疫原性和较高稳定性的全人抗 BCMA 特异性单链抗体,在没有肿瘤相关靶点的情况下,可降低 CAR 细胞的自动激活。
其中一项由北京朝阳医院陈文明教授主持汇报的,旨在探讨 CT053 可持续性疗效和安全性的研究表明,在 14 例接受 CT053 治疗的复发/难治多发性骨髓瘤受试者中,整体耐受性良好显示出产品有较高的安全性,整体 12 个月无进展生存 (PFS) 率为 85.7%,在未合并髓外病变(EMD)的 12 例受试者中 12 个月 PFS 率达到 100%,展示出较高的可持续性疗效。
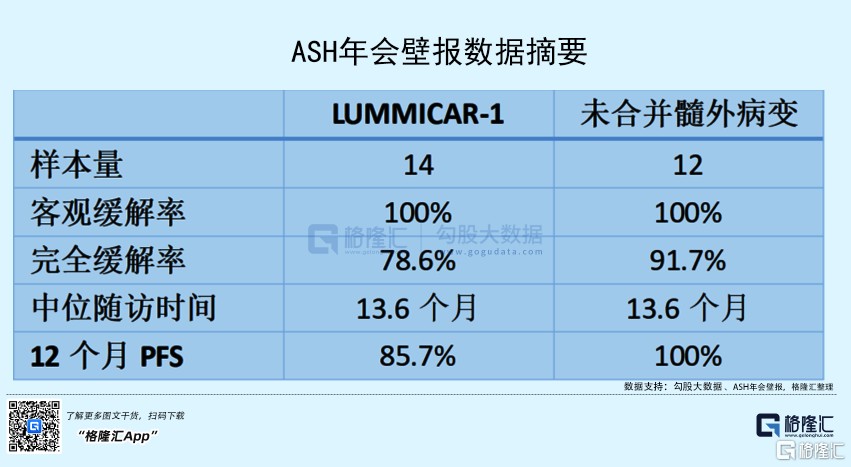
在另一项由苏州大学附属第一医院傅琤琤教授主持汇报的研究表明,CT053 对有合并髓外病变、高危细胞遗传学及 ISS III 期受试者显示出很好的临床获益,而未合并高危因素受试者的疗效更显著,CT053 在复发/难治多发性骨髓瘤受试者(包括高危因素受试者)中是一种非常有前景的治疗选择。
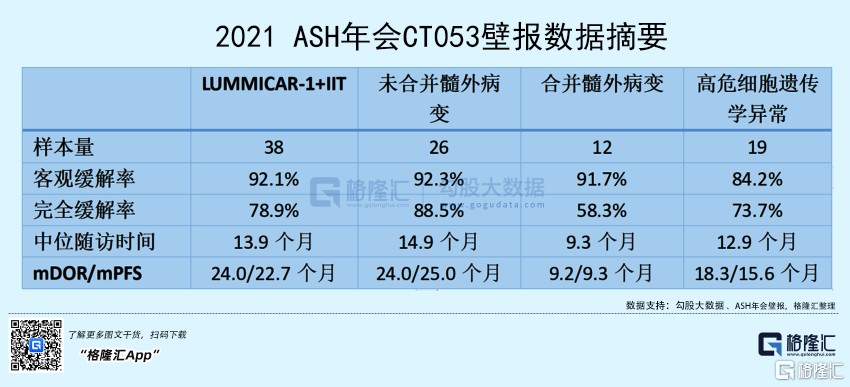
从总体的数据来看,CT053 在复发/难治多发性骨髓瘤受试者身上都显示出较为明显的临床获益,整体的客观缓解率可以达到 92.1%。
目前,科济药业已完成Ⅰ期试验,并分别在中国开展Ⅰ/Ⅱ期临床试验(LUMMICAR STUDY 1)和在北美开展 1b/2 期临床试验(LUMMICAR STUDY 2)的关键 2 期试验部分,以评估 CT053 用于治疗复发/难治多发性骨髓瘤的安全性及疗效。科济药业计划于 2022 年上半年向中国国家药监局及于 2023 年上半年向美国 FDA 提交上市批准的监管申请。公司也计划进行其他临床试验以开发 CT053 作为多发性骨髓瘤的早线治疗方法。
当前,国内获批的 CAR-T 产品适应症均为复发或难治性大 B 细胞淋巴瘤 (DLBCL),在复发/难治多发性骨髓瘤领域(R/R MM)尚未有 CAR-T 产品上市。参考已上市 CAR-T 产品在治疗血液瘤时体现出的突破性疗效,科济药业 CT053 有望填补在复发/难治多发性骨髓瘤领域细胞疗法空白,为患者带去更多有前景的治疗选择。
总体来看,结合科济药业正在重点发展的多个专业技术,公司正在提前布局产品管线,储备下一代细胞治疗产品,以应对未来潜在的价格竞争。在技术上的领先,将会为公司创造持续的长远价值。
3
如何看待未来的科济药业
从短期来看,从公司近期一系列的动态就可以看出来,科济药业无论是最具看点的实体瘤与血液瘤领域还是下一代的细胞治疗领域,都在释放公司研发积极信号,这对于生物科技公司而言是非常关键的。
那么,从长远来看应当如何来看科济药业?笔者认为,可以从公司发展规划、投资价值以及股价层面三个维度进行考量。
从发展规划上看,科济药业明显在走依托技术实现国际化的道路。在临床开发上,相较于其他公司研发只在国内布局完成试验,科济药业的 CAR-T 产品研发选择在国际多中心进行,这在国内 CAR-T 企业里很少见,也为公司未来产品实现国际化铺平道路。
在生产能力上,当前科济药业在上海徐汇、金山及美国的达勒姆市拥有生产基地,具备端对端的质粒、病毒载体及 CAR-T 细胞生产能力。其中,科济药业在金山区的 GMP 生产工厂取得了中国第一张 CAR-T 细胞疗法的药品生产许可证,预计每年可支持多达 2000 名患者的 CAR-T 治疗。此外,公司近期在北卡罗来纳州三角研究园(RTP)区域建设的 cGMP 生产工厂已正式启动生产运营,成为公司全球首个启动运营的中国以外的工厂。

在研发投入上,为了能发挥中、美两地都有生产基地的优势,力争能开发出更具优势的产品,科济药业持续性加大研发投入,引入国际化高端人才,研发出 CycloCAR、THANK-uCAR 等技术来解决 CAR-T 细胞疗法实际应用的困难,使产品疗效持续性及患者可及性得到改善。
科济药业的发展历史是围绕技术研发的闭环,得益于不断投入,科济药业也正在快速取得成果。截至 2021 年 12 月 31 日,公司已在全球申请专利 300 余件,其中授权专利 65 件,仅 2021 年一年即新增专利申请近百件。独立自主的技术实力正在支撑科济药业长期发展规划。
从投资价值的维度来看,评判的是有无将科学技术转化为商业利益的能力。从近期利益来看,即将实现商业化的 CT053 有较国际同类产品更优的临床数据。中长期来看,科济药业的产品领先于众多药厂涉足实体瘤领域,成为现有治疗手段的补充,将 CAR-T 产品市场空间大大增强。
值得注意的是,凭借着优异的临床数据表现,科济药业也在积极布局 “出海”,加速全球商业化进程。
2022 年 1 月,在制药领域深耕约 30 年,拥有丰富的跨国公司和生物技术公司领导经验的 Richard John Daly 先生入职科济药业旗下美国公司 CARsgen Therapeutics Corporation,并担任该旗下公司总裁,领导公司除中国以外地区的国际商业活动,包括临床开发、制造运营、业务发展、商业化、投资者关系以及公共关系,有望进一步助力公司在全球市场开疆拓土。
此前,科济药业也吸引了一批具有丰富经验的国际化人才加入,如担任科济药业全球注册事务高级副总裁的范勇博士,范博士曾在美国 FDA 担任审核员长达十余年,负责审查 IND 申请、BLA 和医疗器械,期间获得 FDA 杰出服务奖及 CBER 技术卓越奖。
从长远来看,科济药业自主研发的技术可以使 CAR-T 细胞治疗通用性、疗效持续性、可及性再上数个台阶,能在未来的行业竞争中为自身争得一席之地。因而单纯从商业利益观察,科济药业产品管线及技术设置兼顾远中近期利益,整体投资逻辑亦能自洽。

4
小结
在众多进入 CAR-T 细胞治疗领域的医药公司仍在围绕血液瘤领域 “内卷” 的时候,科济药业已经前瞻性地把目光移向潜在市场更为广阔的实体瘤领域。
正如前文所提到的,科济药业的两款核心候选产品曾先后在全球多个国家和地区获得重要认定,科济药业是中国唯一一家有 2 个产品获得美国 FDA 再生医学先进疗法资格(RMAT)认定的中国 CAR-T 公司,也是全球唯一一家有 2 个 CAR-T 产品被纳入 PRIME 计划的公司。不管是获得 PRIME 还是 RMAT,都将缩短药品的审评时间,加速药品上市,而这些都来自于公司长期坚持的自主研发创新。
随着产品商业化的临近、技术优势转化为可评判的专利数目、科学技术转化为商业利益,市场也将越来越熟悉科济药业,看到它在同业竞争中的差异化优势,察觉它所具备的先机,越发期待它的价值。
