
与辉瑞 Paxlovid 头对头!君实新冠口服药 VV116 新开 3 期临床 | 见智研究

该方案充分满足了临床伦理,也体现了君实对 VV116 的信心。
4 月 19 日,中国临床试验注册中心文件显示,上海市瑞金医院申请注册了《一项评价 JT001(VV116)对比 Paxlovid 早期治疗轻 - 中度新型冠状病毒肺炎(COVID-19)有效性和安全性的多中心、单盲、随机、对照临床研究》。
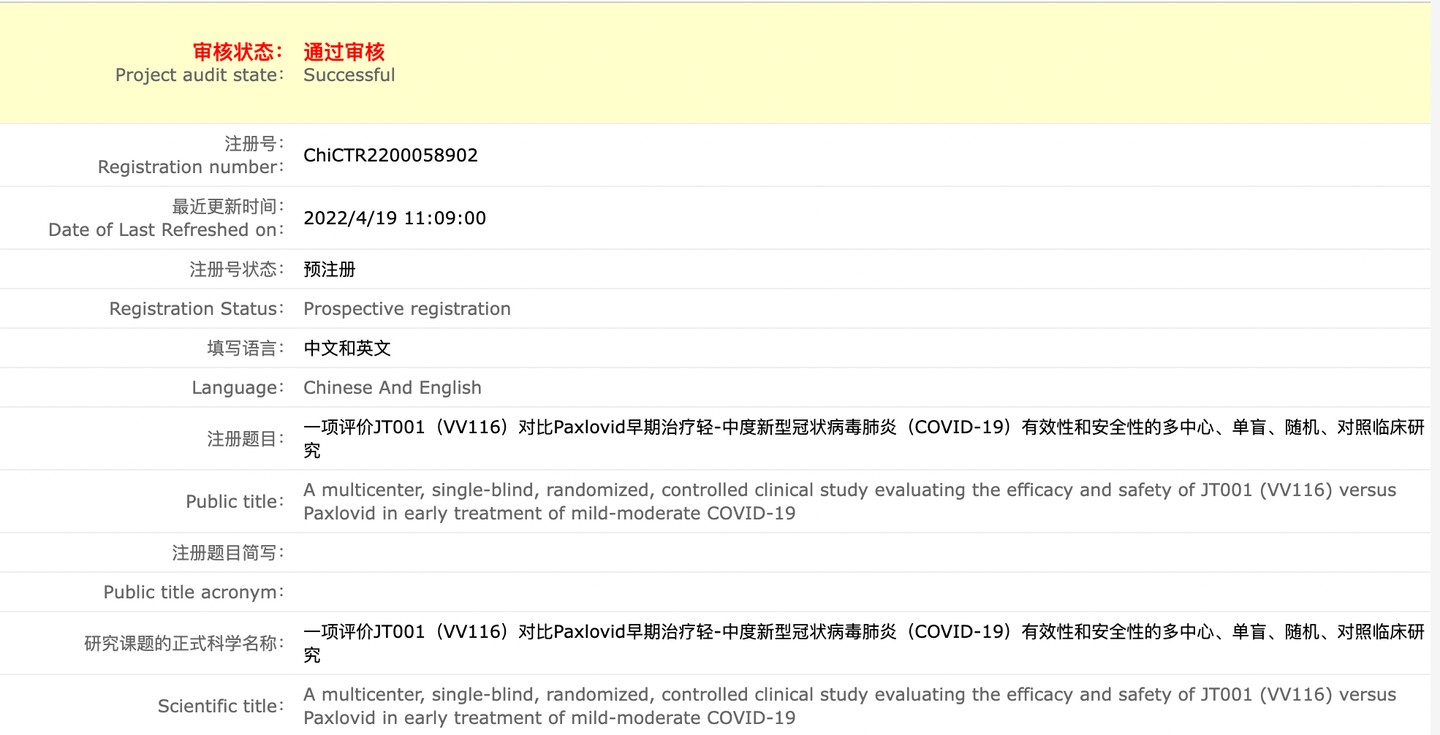
此次研究将入组 480 例患者,使用 VV116 与 Paxlovid 各 240 人,3 期临床试验从 2022 年 4 月 1 日至 2022 年 12 月 31 日。入组人员为有基础疾病的,且症状评分≥2 分的新冠确诊病人。试验地点为上海市瑞金医院。
华尔街见闻·见智研究认为,由于目前上海新冠疫情,该临床会快速实现全部入组,且目前该临床已开始入组。

在临床注册文件中,此次研究目的共有 5 项:
1、评价 JT001(VV116)与 Paxlovid 相比对总体受试者临床状况的影响
2、评价 JT001(VV116)与 Paxlovid 相比安全性特征
3、评价 JT001(VV116)与 Paxlovid 相比截至第 28 天 COVID-19 临床变化
4、评价 JT001(VV116)与 Paxlovid 相比截至第 14 天的 SARS-CoV-2 的变化
5、评价 JT001(VV116)与 Paxlovid 相比截至第 10 天胸部 CT 扫描的变化
该临床试验的主要指标为
1)至持续临床恢复的时间(截至第 28 天)
2)截至第 28 天发生 COVID-19 进展(定义为进展为重度/危重 COVID-19 或全因死亡)的受试者百分比。

见智研究认为,由于 Paxlovid 已获紧急批准进入《新型冠状病毒肺炎诊疗方案(试行第九版)》,成为新冠指南推荐用药,此次 VV116 选择头对头 Paxlovid 进行临床,也充分符合满足病人临床紧急需求的伦理要求,使得有基础疾病的高风险新观患者能够获得有效的治疗。同时也体现了君实/旺山旺水对该产品疗效的信心。
VV116 由中国科学院上海药物研究所、中国科学院武汉病毒研究所、旺山旺水生物医药有限公司联合研发,2021 年 9 月,君实生物与旺山旺水达成合作协议之后共同承担 VV116 在全球范围内的临床开发和产业化工作。
Paxlovid 是 3CL 蛋白酶抑制剂 nirmatrelvir 与低剂量利托那韦 (Ritonavir) 的复方制剂,由 300mg(两片 150mg 片剂)的 nirmatrelvir 和一片 100mg 的利托那韦片进行组合给药供新冠患者口服,每日给药 2 次,持续 5 天。目前 Paxlovid 已获得中国药监局附条件紧急批准使用,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎 (COVID-19) 患者,并进入新冠治疗手册第九版。
此外,君实在 1 月 26 日公告,与旺山旺水共同开发靶向 3CL 蛋白酶的可口服抗新冠病毒候选新药 VV993,该靶点与辉瑞新冠口服药相同。同时公司还宣布 VV993 未来可能将与 VV116 联用,发挥更大效果。

